#MONDE_TEST_COVIC19: Bamlanivimab, premier médicament autorisé par les Etats-Unis contre le Covid-19
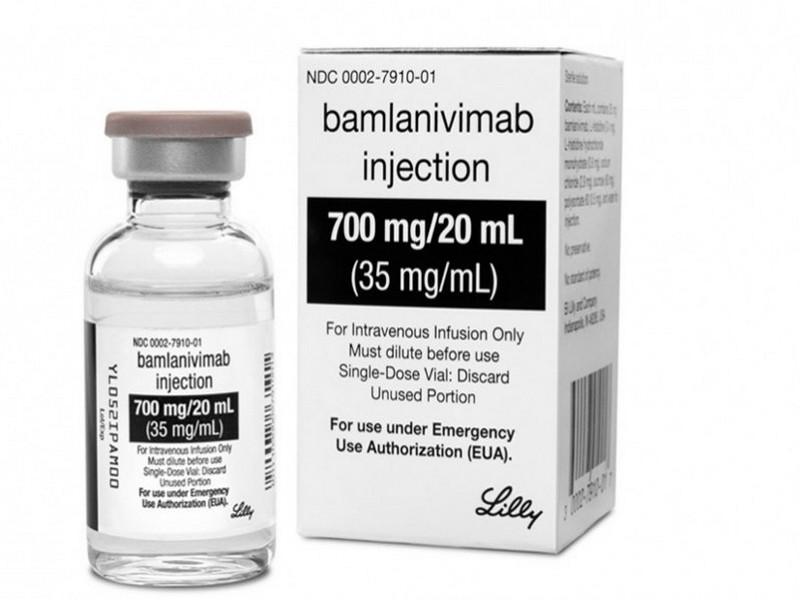
La Food and Drug Administration des Etats-Unis a délivré, le 9 novembre, une autorisation d'utilisation d'urgence (EUA) pour le traitement expérimental par anticorps monoclonaux Bamlanivimab pour le traitement du Covid-19 léger à modéré, chez les patients adultes et pédiatriques.
Le Food and Drug Administration des Etats-Unis est autorisé chez les patients ayant obtenu des résultats positifs au test viral direct du Sars-CoV-2, âgés de 12 ans et plus, pesant au moins 40 kilogrammes et présentant un risque élevé d'évolution vers un Covid-19 sévère et/ou hospitalisation. Cela comprend les personnes âgées de 65 ans ou plus ou qui souffrent de certaines maladies chroniques, explique la FDA, l'agence du département américain de la Santé et des services sociaux.
"Bien que l'innocuité et l'efficacité de ce traitement expérimental continuent d'être évaluées, il a été démontré dans les essais cliniques que le Bamlanivimab réduit les hospitalisations ou les visites à l'urgence liées au Covid-19 chez les patients à haut risque de progression de la maladie dans les 28 jours suivant le traitement par rapport au placebo", ajoute la même source.
Le Bamlanivimab n'est pas autorisé chez les patients hospitalisés en raison du Covid-19 ou nécessitant une oxygénothérapie: un effet du traitement par Bamlanivimab n'a pas été démontré chez ces patients. Les anticorps monoclonaux, tels que le Bamlanivimab, peuvent être associés à de pires résultats cliniques lorsqu'ils sont administrés à des patients hospitalisés nécessitant de l'oxygène à haut débit ou une ventilation mécanique.
"Les anticorps monoclonaux sont des protéines de laboratoire qui imitent la capacité du système immunitaire à lutter contre les antigènes nocifs tels que les virus. Ce médicament est un anticorps monoclonal spécifiquement dirigé contre la protéine de pointe du Sars-CoV-2, conçu pour bloquer l'attachement du virus et son entrée dans les cellules humaines."
"L'autorisation d'urgence du Bamlanivimab par la FDA fournit aux professionnels de la santé en première ligne de cette pandémie un autre outil potentiel dans le traitement des patients atteints de Covid-19", a déclaré Patrizia Cavazzoni, directrice par intérim du Center for Drug Evaluation and Research de la FDA. "Nous continuerons d'évaluer les nouvelles données sur l'innocuité et l'efficacité du Bamlanivimab dès qu'elles seront disponibles."
Les données étayant cette EUA pour le Bamlanivimab sont basées sur une analyse intermédiaire d'un essai clinique de phase 2 chez 465 adultes non hospitalisés présentant des symptômes légers à modérés du Covid-19. Parmi ces patients, 101 ont reçu une dose de 700 milligrammes de Bamlanivimab, 107 ont reçu une dose de 2.800 milligrammes, 101 ont reçu une dose de 7.000 milligrammes et 156 ont reçu un placebo dans les trois jours suivant l'obtention de l'échantillon clinique pour le premier Sars-CoV- positif.
L'EUA permet au Bamlanivimab d'être distribué et administré en une seule dose par voie intraveineuse par les prestataires de soins de santé.
Les effets secondaires possibles du médicament comprennent anaphylaxie et réactions liées à la perfusion, nausées, diarrhée, étourdissements, maux de tête, démangeaisons et vomissements.
Le 10 novembre 2020
SOURCE WEB PAR Médias 24
Les tags en relation
Les articles en relation

La Banque Mondiale confirme une récession économique durable au Maroc
Malgré ces acquis, le même rapport souligne que « le choc soudain de la Covid-19 a entraîné l’économie dans une abrupte récession, la première depuis ...

Selon Edward Snowden, le Covid-19 pourrait conduire à une surveillance étatique étendue et durabl
De nombreux pays ont déjà mis en place des systèmes de surveillance utilisant l'intelligence artificielle afin de lutter contre la pandémie de Covid-19....

Plan de relance du tourisme: les professionnels avancent leurs pions
Bien qu’il soit encore trop tôt pour parler de reprise, les professionnels du tourisme préparent déjà l’après-Covid-19 pour ne pas rater le coche. L...

Les Marocains pourront se rendre en Espagne dès le 1er juillet
Le déconfinement se poursuit en Europe avec l’ouverture des frontières prévue le 21 juin prochain par l’Espagne. Grâce à cette décision, les Marocains...

Transport aérien Une baisse de 37% de la demande mondiale attendue cette année
En raison de la crise du Covid-19, le transport aérien souffre fortement de la réduction drastique des flux de personnes et de marchandises. Selon Euler Herme...

Covid-19 : la Chine annonce 1.367 cas asymptomatiques
La Chine a annoncé que 1.367 personnes sont actuellement testées positives au nouveau coronavirus mais asymptomatiques, c’est-à-dire n’ayant pas la toux ...

Reprise du trafic aérien : Une décision gouvernementale imminente ?
Au regard de l’évolution positive de la situation épidémiologique, une source ministérielle nous déclare que la reprise du trafic aérien avec les march�...

Le CRT d’Agadir s’ouvre sur le post-Corona
Dans une brève déclaration de Rachid Dahmaz, président du Conseil Régional de Tourisme d’Agadir Souss Massa (CRT), à Télégramme, la confection d’un s...

Maroc : très en colère, Mohammed VI sanctionne lourdement Casablanca
Le roi du Maroc, Mohammed VI, très en colère contre la situation qui prévaut dans son pays, principalement le comportement des populations de Casablanca, a i...

Au Maroc, le coronavirus ne peut plus être stoppé, mais on peut encore sauver des vies
Par Youssef Oulhote, docteur en épidémiologie et biostatistique, enseignant-chercheur à l’Université du Massachusetts et à l’École de Santé Publique ...

PAROLE DE PRO : Marketing de la reprise
Premium Travel News continue de recevoir les contributions de professionnels pour alimenter le débat sur les questions de l’heure. Et c’est de bonne guerre...


 jeudi 12 novembre 2020
jeudi 12 novembre 2020 0
0 







































 Découvrir notre région
Découvrir notre région